Kindly complete the form below to receive a free sample of this Report

世界の医薬品安全性監視市場の概要
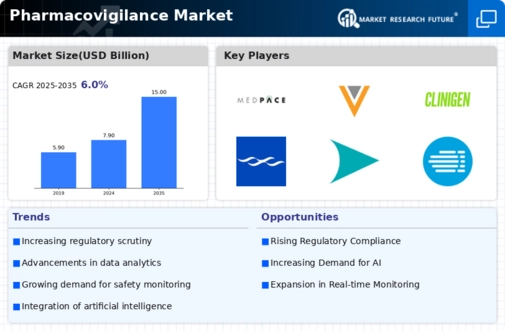
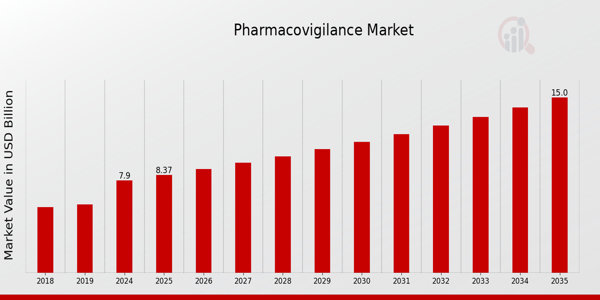
MRFRの分析によると、医薬品安全性監視市場の規模は2023年に74.5億米ドルと推定されています。医薬品安全性監視市場産業は、2024年の79億米ドルから2035年には150億米ドルに成長すると予想されています。医薬品安全性監視市場のCAGR(年平均成長率)は、予測期間(2025~2035年)中に約6.0%になると予想されています。
主要な医薬品安全性監視市場の動向のハイライト
医薬品安全性監視市場は、いくつかの主要な市場推進要因によって大きな変化を遂げています。患者の安全性と規制遵守の重要性の高まりは、世界中の製薬会社と医療規制当局にとって最大の関心事となっています。医薬品の安全性確保に重点が置かれていることから、組織は堅牢な医薬品安全性監視システムとプロセスに多額の投資を行うようになっています。さらに、薬物有害反応の発生率の上昇と医薬品安全性の問題をタイムリーに検出する必要性から、医療提供者は報告メカニズムの強化を迫られ、市場の成長が促進されています。検討すべき機会としては、医薬品安全性監視活動への人工知能や機械学習などの先進技術の統合が挙げられます。
これらの技術は、データの収集、分析、報告を合理化し、医薬品の安全性監視の効率と精度を向上させます。さらに、組織がデータのアクセシビリティとコラボレーション機能を強化しようとする中で、クラウドベースのソリューションが普及しつつあります。医薬品安全性監視市場の最近の傾向では、製薬会社、規制当局、テクノロジープロバイダー間のパートナーシップとコラボレーションが増加しています。この共同アプローチは、データ共有を改善し、医薬品安全性監視フレームワークを強化してコンプライアンスを確保し、医薬品安全性対策の全体的な有効性を高めるために不可欠です。
さらに、臨床試験と医薬品承認の進行中のグローバル化により、多様な規制環境と患者の人口統計に対応する、より積極的な医薬品安全性監視戦略が必要になっています。これらの要因の収束は、最終的には、世界規模で医薬品の安全性と患者の転帰を改善する取り組みを特徴とする、ダイナミックな市場環境を示しています。
出典: 一次調査、二次調査、MRFR データベース、アナリストレビュー
医薬品安全性監視市場の推進要因
医薬品安全性に関する規制要件の増加
医薬品の安全性維持を目的とした規制の増加は、医薬品安全性監視市場の成長を大きく促進しています。欧州医薬品庁 (EMA) や米国食品医薬品局 (FDA) などの規制当局は、長年にわたり厳格な医薬品安全性監視基準を課してきました。例えば、FDAのREMS(リスク評価および軽減戦略)プログラムでは、製薬会社に対し、医薬品関連のハザードを適切に監視および管理するためのリスク管理戦略を策定することを義務付けています。
これらの規制を遵守するため、企業は医薬品安全性監視システムへの投資を増やしています。世界保健機関(WHO)によると、規制当局はすべての医薬品安全性通知の40%以上を発行しており、徹底した医薬品安全性監視イニシアチブの必要性が大幅に増加していることを示しています。この動きは、患者の安全性に対応するだけでなく、これらの医薬品が市場で引き続き入手可能であることを保証し、医薬品安全性監視市場の成長を促進します。
薬物有害反応の増加
薬物有害反応(ADR)の発生率の増加は、医薬品安全性監視市場産業を大幅に後押しする差し迫った懸念事項です。米国医学研究所の報告書によると、米国では毎年約150万人が医薬品関連のエラーによって被害を受けており、医療費と入院の増加につながっていると推定されています。この憂慮すべき統計は、効果的な医薬品安全性監視の実践が緊急に必要であることを浮き彫りにしています。
ノバルティスやジョンソン・エンド・ジョンソンなどの製薬会社は、リスクを軽減するためにADRのモニタリングに力を入れています。ADRの認識と報告の増加は、患者の安全性を高めるだけでなく、包括的な医薬品安全性監視システムの開発を促進し、医薬品安全性監視市場の成長に直接貢献します。
医薬品安全性監視における技術の進歩
技術の進歩は、医薬品安全性監視市場産業の前進に極めて重要な役割を果たしています。人工知能(AI)や機械学習などのイノベーションは、データの収集と分析の方法に革命をもたらし、副作用のより迅速かつ正確な検出を可能にしています。 Journal of Biomedical Informatics に掲載された研究によると、AI 統合システムは医薬品の安全性シグナル検出を 30% 以上改善できることを示しています。
Oracle や Veeva Systems などの企業は、これらのテクノロジーを活用してレポートの精度と効率を高める最先端の医薬品安全性監視ソリューションを開発しています。医薬品開発の複雑さが増し、患者の安全性が重視される中、テクノロジー主導のソリューションの採用は単なるトレンドではなく必需品であり、医薬品安全性監視市場の主要な推進力となっています。
医薬品安全性監視市場セグメントの洞察
医薬品安全性監視市場のサービス タイプに関する洞察
医薬品安全性監視市場は、医薬品の安全性と有効性を確保する上での重要な役割を反映して、サービス タイプ セグメント内で大幅な成長を遂げています。2024 年には、市場全体の価値は 79 億米ドルに達し、さまざまなサービス分野からの大きな貢献がありました。中でも、有害事象報告は市場の主要な勢力の一つとして浮上し、2024年には25億米ドルと評価され、2035年までに47億米ドルに達すると予測されています。このサービスは、医薬品に関連する安全性の問題を特定して管理する上で不可欠であり、それによって公衆衛生を保護します。
それに続いて、リスク評価の市場評価は2024年に18億米ドルとなり、2035年までに34億米ドルに成長すると予測されています。このサービスは、薬物療法に関連する潜在的なリスクを評価する上で不可欠であり、規制遵守と患者の安全性において重要です。データマイニングは、2024年に16億米ドルと評価され、2035年には30億米ドルに達すると予測されており、膨大な量の医療データから貴重な洞察を抽出して医薬品安全性監視業務を強化する上での重要性を示しています。最後に、医薬品安全性監視コンサルティングは、2024年には10億米ドルと最も小さいサービスセグメントですが、2035年までに19億米ドルに成長すると予想されており、組織が医薬品安全性規制とベストプラクティスの複雑さを乗り越えるために専門家の指導を求めるにつれて、その重要性が高まっていることを示しています。
この多様なセグメンテーションは、医薬品安全性監視市場の多面的な性質を浮き彫りにしており、各サービスタイプは、医薬品の安全性を監視する際の固有の課題と機会に対処する上で重要な役割を果たしています。主な成長要因としては、規制要件の強化、薬物使用に関連する有害事象の増加、世界の医療環境における医薬品安全性監視の重要性に対する認識の高まりなどがあり、これらすべてが継続的な市場開発のための強力な環境を作り出しています。

出典:一次調査、二次調査、MRFRデータベース、アナリストレビュー
医薬品安全性監視市場の導入モード洞察
医薬品安全性監視市場、特に導入モードセグメントは大幅な成長が見込まれており、2024年には市場規模が79億米ドルに達すると予想されています。このセグメントには、クラウドベースとオンプレミスの2つの主要モードが含まれます。クラウドベースのソリューションは、拡張性、費用対効果、アクセスの容易さから、ますます人気が高まっています。リアルタイムのデータ統合と関係者間のコミュニケーションを可能にするため、これは効果的な医薬品安全性監視に不可欠です。オンプレミスシステムは従来から利用されてきましたが、組織がより柔軟で効率的なソリューションを求めるにつれて、その人気は低下しています。
規制要件の強化と患者の安全性への重点化は、医薬品安全性監視市場の成長を牽引する主要な要因です。さらに、技術インフラとデータ分析の進歩は、監視システムの強化の機会を生み出しています。市場全体の成長は、世界中の保健当局にとって極めて重要な、医薬品の安全性と有効性の確保への関心の高まりによって補完されています。このようなさまざまなトレンドの組み合わせにより、展開モード セグメントは医薬品安全性監視市場の収益における重要な領域として位置付けられ、業界の展望に大きく貢献しています。
医薬品安全性監視市場のソースに関する洞察
医薬品安全性監視市場、特にソース セグメントは、2024 年までに 79 億米ドルに達すると予想される市場評価を特徴とする大幅な成長軌道を反映しています。自発報告は、医薬品安全性データの収集において重要な方法として機能し、医療従事者と患者が有害事象を効率的に報告できるようにすることで、迅速な規制対応を促進します。文献レポートも同様に重要な役割を果たしており、公開されているさまざまな研究の調査結果を統合し、医薬品安全性プロファイルの包括的な理解を可能にします。
定期報告も重要ですが、定義された間隔で体系的な評価が行われることを保証し、長期にわたって医薬品安全性監視を維持するのに役立ちます。市場が進化を続ける中、これらの報告メカニズムを支えるテクノロジーとデータ分析の進歩に重点が置かれ、医薬品安全性監視プロセスのさらなる効率化が進む傾向が見られます。規制の強化と医薬品安全性に対する意識の高まりにより、堅牢な医薬品安全性監視システムの必要性が高まり、業界におけるこれらの報告ソースの重要性がさらに高まっています。
医薬品安全性監視市場のエンドユーザーインサイト
医薬品安全性監視市場は、製薬会社、バイオテクノロジー企業、および開発業務受託機関(CRO)の多大な貢献により、さまざまなエンドユーザーを中心に構築されています。2024年には、市場規模は79億米ドルに達すると予想されており、世界規模で医薬品の安全性と有効性を確保する上でこれらのエンドユーザーの重要性を示しています。製薬会社は、広範なデータを用いてリスク評価と緩和戦略を実施し、自社製品の安全性プロファイルを積極的に監視・管理することで、医薬品安全性監視において重要な役割を果たしています。
革新的な治療法を頻繁に開発するバイオテクノロジー企業は、生物学的製剤に関連する複雑さと特有の安全性上の課題を乗り越えるために、堅牢な医薬品安全性監視システムに大きく依存しています。開発業務受託機関は、医薬品安全性監視プロセスにおいて重要なパートナーとして機能し、製薬会社とバイオテクノロジー会社の両方の報告とコンプライアンスへの取り組みを合理化する専門知識とサービスを提供しています。規制要件の増加と患者の安全性の重視が、これらのセグメントの市場成長を促進しています。
医薬品承認数の増加と継続的なモニタリングの必要性により、これらの主要なエンドユーザーにおける効果的な医薬品安全性監視慣行の需要は引き続き高く、医薬品安全性監視市場におけるその重要性が強化されると予想されます。高度なテクノロジーと分析ツールは、これらの企業の能力をさらに強化し、市場拡大の十分な機会を提供しています。
医薬品安全性監視市場の地域別洞察
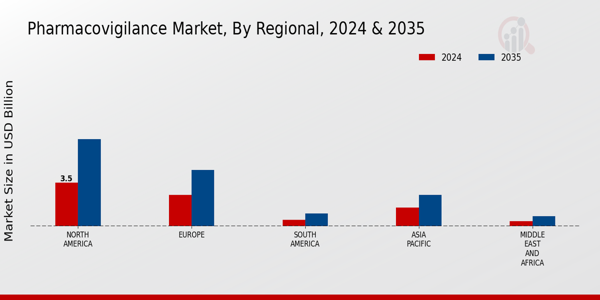
医薬品安全性監視市場の収益はさまざまな地域によって大きく左右されますが、北米がトップを走り、2024年には35億米ドルと評価され、2035年には70億米ドルに成長すると予測されており、厳格な規制と高度な医療インフラにより、市場シェアで優位に立つことが見込まれています。欧州はこれに続き、医薬品の安全性と副作用報告に対する意識の高まりにより、2024年の評価額は25億米ドルとなり、2035年には45億米ドルに達すると予想されています。アジア太平洋地域は、2024年に15億米ドルと評価され、2035年までに25億米ドルに拡大すると予測されており、医薬品セクターの急成長と人々のヘルスケア需要の高まりにより、大きな成長の機会が生まれています。
南米と中東およびアフリカはより小規模なセグメントで、南米は2024年に5億米ドルと評価され、2035年までに10億米ドルに達すると予測されています。また、中東およびアフリカは2024年に4億米ドルと評価され、2035年までに8億米ドルに成長すると予想されています。これらの地域では、規制の枠組みの進化と患者の安全性の向上への重点により、より確立された市場と比較すると遅いペースではありますが、医薬品安全性監視の実践への関与を徐々に増やしています。医薬品安全性監視市場業界では、あらゆる地域でコンプライアンスを確保し、データ管理の効率を高めるために、デジタル化や自動化など、さまざまなトレンドが見られます。
出典:一次調査、二次調査、MRFRデータベース、アナリストレビュー
医薬品安全性監視市場の主要プレーヤーと競合に関する洞察
医薬品安全性監視市場の競争環境は、医薬品の安全性とリスク管理に重点を置くさまざまな企業のダイナミックな相互作用によって特徴付けられます。患者の安全性の重要性が医療分野全体に響き渡る中、この市場の組織は、提供内容を強化し、進化する規制要件に適応することを余儀なくされています。企業は、コンプライアンスを維持し、規制当局と医療提供者の両方の期待に応えるために、戦略的コラボレーション、技術の進歩、プロセスの継続的な改善に取り組んでいます。競争の激しい環境には、大手製薬会社、専門サービスプロバイダー、そして医薬品安全性監視業務における拡張性と効率性を重視するテクノロジー主導の組織が混在しています。これらの企業は、イノベーションとデータ統合の重視を通じて、市場での地位を強化し、世界中のさまざまな地域での成長機会を活かすことを目指しています。
Medpaceは、包括的な臨床開発サービスと、安全性および規制遵守への強いコミットメントにより、医薬品安全性監視市場で際立った存在です。フルサービスの臨床研究機関であるMedpaceは、スポンサーに対し、医薬品開発のあらゆる段階をサポートする統合プラットフォームを提供しています。同社は、確立されたグローバル拠点を活用し、さまざまな地域で効率的に事業を展開しています。Medpaceは、高品質の医薬品安全性監視サービスの提供、臨床試験データの堅牢性の向上、国際安全基準の遵守の確保に注力する、経験豊富な専門家チームを擁しています。さらに、イノベーションと適応性への注力により、Medpaceは進化する規制環境に効果的に対応し、医薬品安全性監視分野における競争力を強化しています。
Veeva Systemsは、クラウドベースのソフトウェアソリューションにおける専門知識を活用して医薬品安全性管理を強化し、医薬品安全性監視市場で重要な地位を占めています。同社のVault Safetyソリューションは、有害事象報告、シグナル検出、規制当局への申請など、主要な医薬品安全性監視プロセスに対応し、データの完全性と運用効率を向上させます。Veeva Systemsは、世界中の製薬企業やバイオテクノロジー企業の特定のニーズに応える、革新的で拡張性の高いソリューションの提供に注力していることで知られています。Veevaの製品の強みは、堅牢なテクノロジープラットフォームだけでなく、強固な顧客関係と包括的なトレーニングサポートにもあります。Veevaは、サービス提供をさらに強化し、市場リーチを拡大するために戦略的な合併や買収を行い、医薬品安全性監視における能力を継続的に強化しています。市場の需要への適応力とイノベーション推進への継続的な取り組みにより、Veevaはグローバルなファーマコビジランス市場における主要プレーヤーとしての地位を確固たるものにしています。
ファーマコビジランス市場の主要企業
- Medpace
- Veeva Systems
- Clinigen Group
- Charles River Laboratories
- PharmaLex
- IQVIA
- Cognizant
- Syneos Health
- PAREXEL International
- Wipro
- Capgemini
- Covance
- Accenture
- Veristat
ファーマコビジランス市場の業界動向
最近の動向医薬品安全性監視市場における最近の動向は、技術の進歩と規制遵守への大きな重点を示しています。Veeva SystemsやIQVIAなどの企業は、COVID-19後の医薬品安全性監視活動の急増によりますます重要になっている医薬品安全性報告を合理化するためのクラウドベースのソリューションに多額の投資を行っています。合併と買収の面では、Medpaceが2023年8月にバイオテクノロジー企業を買収して医薬品安全性サービスを強化すると発表し、Clinigen GroupとVeristatはサービスを拡張してデータ分析と報告へのアクセスを向上させました。
市場では、規制要件の複雑化と医薬品開発プロセスにおけるリアルタイムデータ分析の必要性に後押しされ、安全性モニタリングサービスの需要が高まっており、評価額が上昇しています。過去2~3年で、PharmaLexやSyneos Healthなどの企業も、市販後調査における包括的なサポートの需要の高まりに対応して、サービス提供を大幅に拡大しました。この変化し続ける市場環境は、アクセンチュア、コグニザント、パレクセル・インターナショナルといった業界リーダーとの連携により、患者の安全性と薬剤有効性モニタリングを強化する革新的なソリューションを活用する必要性を浮き彫りにしています。
ファーマコビジランス市場のセグメンテーションに関する洞察
ファーマコビジランス市場のサービスタイプ別展望
- 有害事象報告
- リスク評価
- データマイニング
- ファーマコビジランス・コンサルティング
ファーマコビジランス市場の導入形態別展望
- クラウドベース
- オンプレミス
ファーマコビジランス市場の情報源別展望
- 自発的報告
- 文献レポート
- 定期レポート
ファーマコビジランス市場のエンドユーザー展望
- 製薬会社
- バイオテクノロジー企業
- 開発業務受託機関
ファーマコビジランス市場の地域別展望
- 北米
- ヨーロッパ
- 南米
- アジア太平洋地域
- 中東およびアフリカ
Customer Stories

“This is really good guys. Excellent work on a tight deadline. I will continue to use you going forward and recommend you to others. Nice job”

“Thanks. It’s been a pleasure working with you, please use me as reference with any other Intel employees.”

“Thanks for sending the report it gives us a good global view of the Betaïne market.”

“Thank you, this will be very helpful for OQS.”

“We found the report very insightful! we found your research firm very helpful. I'm sending this email to secure our future business.”

“I am very pleased with how market segments have been defined in a relevant way for my purposes (such as "Portable Freezers & refrigerators" and "last-mile"). In general the report is well structured. Thanks very much for your efforts.”

“I have been reading the first document or the study, ,the Global HVAC and FP market report 2021 till 2026. Must say, good info! I have not gone in depth at all parts, but got a good indication of the data inside!”

“We got the report in time, we really thank you for your support in this process. I also thank to all of your team as they did a great job.”