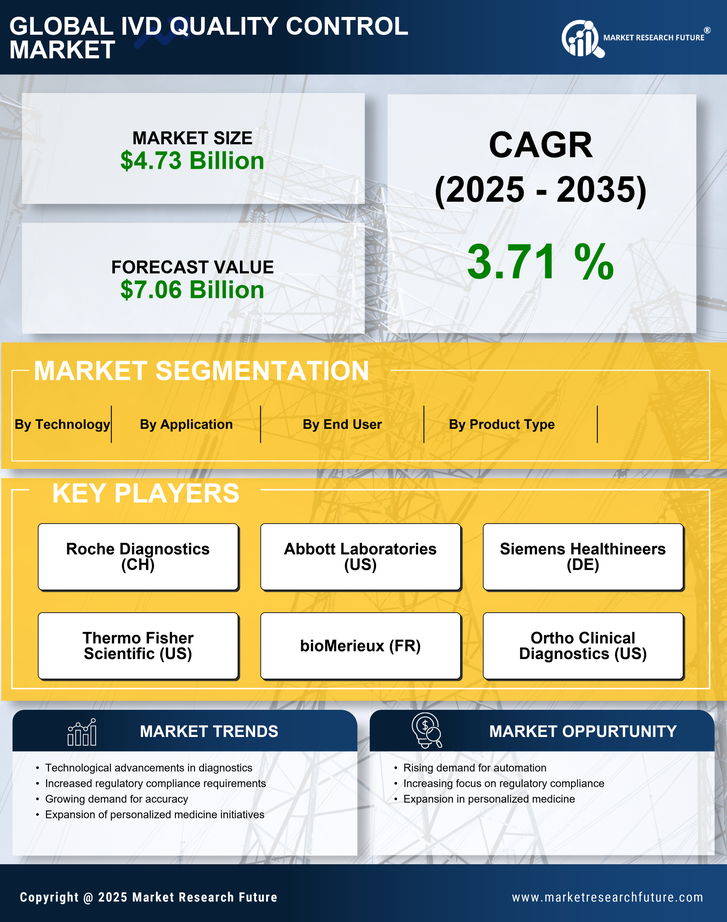
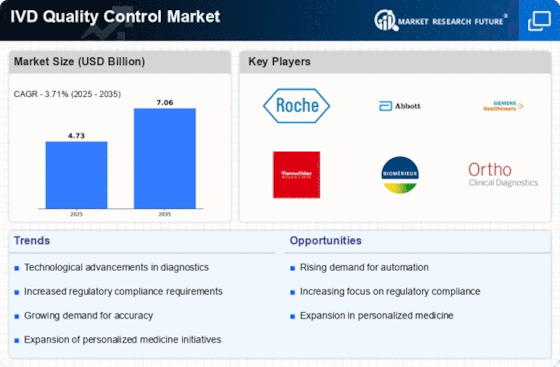
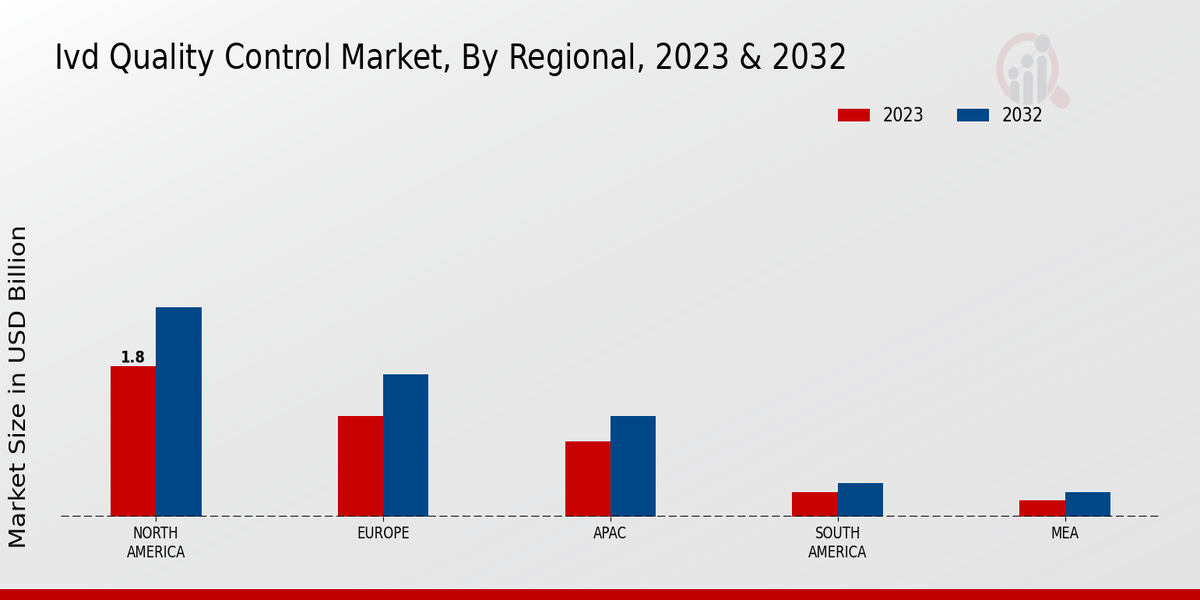
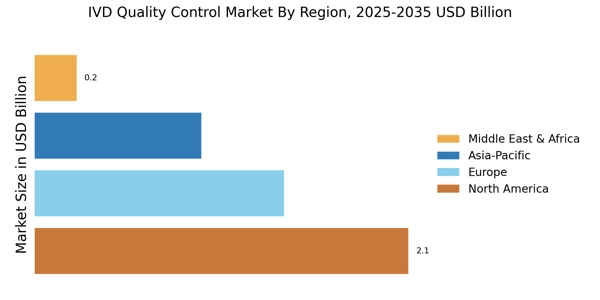
Wachstum der Point-of-Care-Tests
Das Wachstum von Point-of-Care-Tests (POCT) entwickelt sich zu einem bedeutenden Treiber für den IVD-Qualitätskontrollmarkt. POCT ermöglicht schnelle diagnostische Ergebnisse am Ort der Patientenversorgung, was in verschiedenen Gesundheitsbereichen zunehmend bevorzugt wird. Dieser Trend ist besonders relevant in der Notfallversorgung und in abgelegenen Gebieten, wo zeitnahe Entscheidungen entscheidend sind. Mit der steigenden Nachfrage nach POCT wird die Notwendigkeit strenger Qualitätskontrollmaßnahmen von größter Bedeutung, um die Genauigkeit und Zuverlässigkeit dieser Tests sicherzustellen. Der IVD-Qualitätskontrollmarkt muss sich anpassen, um die einzigartigen Herausforderungen zu bewältigen, die durch POCT entstehen, einschließlich des Bedarfs an tragbaren Qualitätskontrolllösungen. Dieser Wandel wird voraussichtlich Innovationen und Investitionen in Technologien zur Qualitätskontrolle anstoßen, die auf Point-of-Care-Anwendungen zugeschnitten sind, und somit den Markt erweitern.
Zunehmende regulatorische Anforderungen
Der IVD-Qualitätskontrollmarkt wird erheblich von den zunehmenden regulatorischen Anforderungen beeinflusst, die von den Gesundheitsbehörden auferlegt werden. Regulierungsbehörden aktualisieren kontinuierlich die Richtlinien, um die Sicherheit und Wirksamkeit von In-vitro-Diagnoseprodukten zu gewährleisten. Die Einhaltung dieser Vorschriften ist für Hersteller unerlässlich, um den Marktzugang aufrechtzuerhalten und Strafen zu vermeiden. Der IVD-Qualitätskontrollmarkt muss sich an diese sich entwickelnden Standards anpassen, die oft verbesserte Qualitätskontrollmaßnahmen erfordern. Beispielsweise kann die Einführung strengerer Qualitätsmanagementprotokolle zu höheren Betriebskosten für die Hersteller führen. Dies bietet jedoch auch eine Wachstumschance, da Unternehmen, die in robuste Qualitätskontrollsysteme investieren, wahrscheinlich einen Wettbewerbsvorteil erlangen. Der Markt wird voraussichtlich wachsen, da Organisationen die Einhaltung priorisieren und innovative Lösungen suchen, um den regulatorischen Anforderungen gerecht zu werden.
Steigende Nachfrage nach genauen Diagnosen
Der zunehmende Fokus auf genaue Diagnosen ist ein Haupttreiber für den Markt für Qualitätskontrolle in der In-vitro-Diagnostik (IVD). Da die Gesundheitssysteme bestrebt sind, die Patientenergebnisse zu verbessern, ist die Nachfrage nach zuverlässigen und präzisen Diagnosetools gestiegen. Diese Nachfrage spiegelt sich im prognostizierten Wachstum des IVD-Marktes wider, der voraussichtlich bis 2025 etwa 100 Milliarden USD erreichen wird. Der Markt für Qualitätskontrolle in der IVD spielt eine entscheidende Rolle dabei, sicherzustellen, dass diagnostische Tests strengen Genauigkeitsstandards entsprechen, wodurch die allgemeine Zuverlässigkeit der Gesundheitsdienstleistungen erhöht wird. Darüber hinaus erfordert der Anstieg chronischer Krankheiten häufige Tests, was den Bedarf an robusten Qualitätskontrollmaßnahmen für IVD-Produkte weiter vorantreibt. Infolgedessen investieren Hersteller zunehmend in Lösungen zur Qualitätskontrolle, um die Einhaltung von Vorschriften zu gewährleisten und die Erwartungen von Gesundheitsdienstleistern und Patienten gleichermaßen zu erfüllen.
Fokus auf Patientensicherheit und Qualitätskontrolle
Der Fokus auf Patientensicherheit und Qualitätskontrolle ist eine treibende Kraft hinter dem IVD-Qualitätskontrollmarkt. Da Gesundheitsdienstleister zunehmend die Patientenergebnisse priorisieren, hat die Nachfrage nach hochwertigen diagnostischen Tests zugenommen. Dieser Fokus spiegelt sich in der wachsenden Einführung von Qualitätsmanagementsystemen wider, die die Zuverlässigkeit von IVD-Produkten gewährleisten. Der IVD-Qualitätskontrollmarkt reagiert auf diesen Trend, indem er umfassende Qualitätskontrollprotokolle entwickelt, die mit den besten Praktiken in der Patientensicherheit übereinstimmen. Darüber hinaus wird der Schwerpunkt auf Qualitätskontrolle voraussichtlich zu einer verstärkten Zusammenarbeit zwischen Herstellern und Gesundheitsdienstleistern führen, was eine Kultur der kontinuierlichen Verbesserung fördert. Infolgedessen wird erwartet, dass der Markt wächst, da die Beteiligten die Bedeutung der Qualitätskontrolle zur Verbesserung der Patientensicherheit und der allgemeinen Gesundheitsqualität erkennen.
Technologische Innovationen in der Qualitätskontrolle
Technologische Innovationen beeinflussen den IVD-Qualitätskontrollmarkt erheblich. Fortschritte in der Automatisierung, künstlichen Intelligenz und Datenanalyse transformieren die Qualitätskontrollprozesse und machen sie effizienter und effektiver. Automatisierte Qualitätskontrollsysteme können beispielsweise menschliche Fehler reduzieren und die Geschwindigkeit der Tests erhöhen, was in klinischen Umgebungen von entscheidender Bedeutung ist. Die Integration von KI in die Qualitätskontrolle ermöglicht eine Echtzeitüberwachung und prädiktive Analysen, die proaktive Maßnahmen ermöglichen, bevor Probleme auftreten. Dieser Wandel hin zu technologiegetriebenen Lösungen wird voraussichtlich zum Wachstum des IVD-Qualitätskontrollmarktes beitragen, da Organisationen bestrebt sind, diese Innovationen zu nutzen, um ihre Betriebseffizienz und Produktzuverlässigkeit zu verbessern. Infolgedessen wird der Markt voraussichtlich einen Zustrom neuer Akteure erleben, die hochmoderne Technologien zur Qualitätskontrolle anbieten.